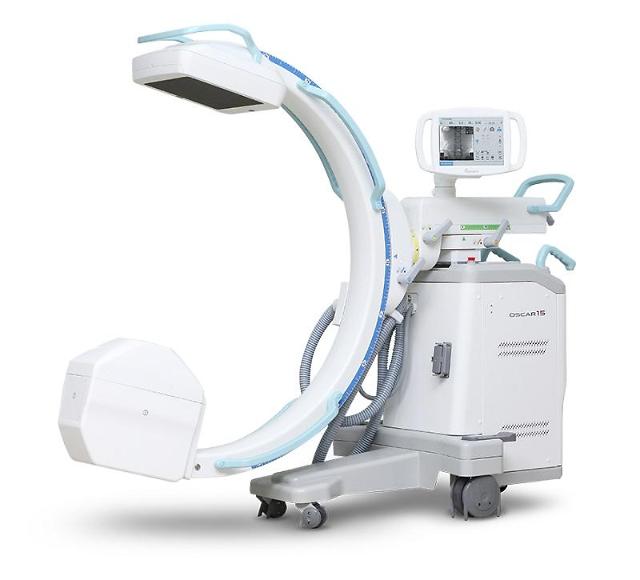
영상진단 의료기기 전문기업 제노레이는 기존 이동형 C-ARM(엑스선 투시 촬영장치)에 이어 디텍터 사양이 추가된 ‘OSCAR 15’, ‘OSCAR 15i’ 제품이 미국 식품의약국(FDA) 510(k) 승인을 받았다고 23일 전했다.
제노레이는 글로벌 의료용 영상진단장비 전문기업으로 연구·개발·판매·고객지원 전 과정을 수행한다. 특히 원천 핵심 기술과 제조 역량을 기반으로 미국, 유럽 등 80여 개국에 제품을 공급해 매출의 75% 이상을 수출에서 거두고 있는 기업이다.
OSCAR 시리즈의 ‘OSCAR 15’는 대면적 3030 FPD(Flat Panel Detector) 기반의 최상급 사양이며, 'OSCAR 15i'는 I.I(Image Intensifier) 기반의 보급형 사양으로 구분됐다.
두 제품 모두 15kW급 고출력 X-ray 제너레이터가 탑재돼 체구가 큰 서양인 체형에 맞게 높은 품질로 영상을 촬영할 수 있다. 고출력 사양으로 최상급, 보급형을 아우르는 제품 라인업으로 미국 내 새 플랫폼을 정착시킬 예정이다.
제노레이 관계자는 "앞으로 현 상황에 안주하지 않고 글로벌 주요 국가에서 적극적인 허가 진행과 영업활동을 진행하며 업계 글로벌 리더로 도약할 것”이라고 전했다.
제노레이는 2001년도에 설립된 글로벌 기업으로 총 5개의 해외법인과 글로벌 45개 파트너를 통해 약 80개국에 제노레이 제품을 수출 중이다.







![[단독] 레거시 줄이고 첨단 메모리 집중… 삼성, 반도체 반등 시동](https://image.ajunews.com/content/image/2024/11/21/20241121140830654754_388_136.jpg)

![[포토] 제8회 서민금융포럼](https://image.ajunews.com/content/image/2024/11/21/20241121114536531007_518_323.jpg)
![[포토] 기조연설 하는 페이커 이상혁](https://image.ajunews.com/content/image/2024/11/20/20241120115246771576_518_323.jpg)
![[포토] 발왕산은 벌써 겨울](https://image.ajunews.com/content/image/2024/11/19/20241119205226273772_518_323.jpg)
![[슬라이드 포토] 제44회 황금촬영상 시상식 참석한 스타들](https://image.ajunews.com/content/image/2024/11/18/20241118194949259743_518_323.jpg)


