김빛내리 기초과학연구원(IBS) RNA 연구단 단장과 장혜식 IBS 연구위원(서울대 생명과학부 교수) 연구팀이 질병관리본부 국립보건연구원과의 공동 연구로 코로나19 고해상도 유전자 지도를 완성했다. 국내 연구진의 노력으로 코로나19 치료제와 백신 개발에 한 걸음 더 가까이 다가섰다는 평가가 나온다.

김빛내리 IBS RNA연구단장.[사진=IBS 제공]
9일 IBS 연구팀은 코로나19 감염증의 원인인 '사스 코로나 바이러스-2(SARS-CoV-2)'의 고해상도 유전자 지도를 완성했다.
연구팀은 두 종류의 차세대 염기서열 분석법(나노포어 직접 RNA 시퀀싱, 나노볼 DNA 시퀀싱)을 활용해 사스 코로나 바이러스-2가 숙주세포 내에서 생산되는 RNA전사체를 모두 분석했다. 이 분석에서 바이러스 유전자의 정확한 위치를 찾아내는 한편, 기존 분석법으로는 확인되지 않았던 RNA들을 찾고, 바이러스의 RNA에 화학적 변형이 최소 41곳에서 일어남을 발견했다.
이를 통해 바이러스 전사체가 어떻게 구성됐는지 이해하고, 바이러스 유전자들이 유전체 상의 어디에 위치하는지를 정확히 파악할 수 있게 됐다. 사스 코로나 바이러스-2 유전자의 복잡하면서도 숨겨진 비밀들을 풀 수 있는 지도를 확보할 수 있게 된 것이다. 또한, 유전체와 전사체에 대한 빅데이터를 생산하여 후속 연구를 위한 다양한 정보도 제공하고 있다.
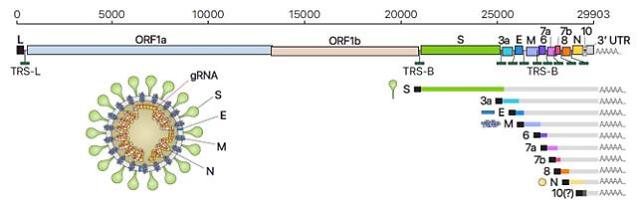
사스 코로나 바이러스-2는 DNA가 아니라 RNA 형태의 유전자를 지니고 있다. 바이러스는 숙주세포에 침투해 유전정보가 담긴 RNA(유전체 RNA·genomic RNA)를 복제하는 한편 유전체 RNA를 바탕으로 다양한 '하위유전체 RNA(subgemomic RNA)'를 생산(전사)한다. 이 하위유전체는 스파이크, 외피 등 바이러스 입자구조를 구성하는 여러 단백질을 합성하며 복제된 유전자와 함께 숙주세포 안에서 바이러스 완성체를 이룬다. 이후 세포를 탈출하여 새로운 세포를 감염시킨다. 숙주세포 안에서 생산된 RNA의 총합을 '전사체(Transcriptome)'라고 한다.
기존 연구에서 사스 코로나 바이러스-2의 유전체 정보가 보고되었지만, 유전체 RNA정보를 기반으로 유전자의 위치를 예측하는 수준에 머물렀다. 김 단장 연구팀은 이번 연구에서 유전체 RNA로부터 생산되는 하위유전체 RNA를 실험적으로 규명하고 각 전사체의 염기서열(유전정보)을 모두 분석해 유전체 RNA 상에 유전자들이 어디에 위치하는지 정확하게 찾아냈다.
기존에는 하위유전체 RNA 10개가 있다고 알려져 있었지만, 이번 실험으로 그중 9개의 하위유전체 RNA만 실제로 존재함을 확인했다. 나머지 하위유전체 RNA 1개에 대한 기존 예측과 다르게 실제로는 존재하지 않는 것으로 확인됐다. 연구팀은 세포 내에서 생산되는 RNA 수십여 종을 추가로 발견했다. 또 융합, 삭제 등 다양한 형태의 하위유전체 RNA 재조합도 빈번하게 일어남을 확인했다.
이와 함께 연구팀은 바이러스 RNA에서 메틸화와 같은 화학적 변형을 발견했다. DNA 메틸화처럼 DNA 수준에서 벌어지는 여러 생화학적 변화를 통칭하여 후성유전체(Epigenome)라 부르는 것처럼, 전사 후 RNA에서 벌어지는 다양한 생화학적 변화는 후성전사체(Epitranscriptome)라 한다. 전사 이후 변형된 RNA들은 기존에 알려지지 않은 새로운 특성을 가질 수 있으므로, 이번에 발견한 변형은 사스 코로나 바이러스-2의 생활사와 병원성을 이해하는 데 도움이 될 전망이다.
연구팀은 두 종류의 차세대 염기서열 분석법(나노포어 직접 RNA 시퀀싱, 나노볼 DNA 시퀀싱)을 활용해 사스 코로나 바이러스-2가 숙주세포 내에서 생산되는 RNA전사체를 모두 분석했다. 이 분석에서 바이러스 유전자의 정확한 위치를 찾아내는 한편, 기존 분석법으로는 확인되지 않았던 RNA들을 찾고, 바이러스의 RNA에 화학적 변형이 최소 41곳에서 일어남을 발견했다.
사스 코로나 바이러스-2는 DNA가 아니라 RNA 형태의 유전자를 지니고 있다. 바이러스는 숙주세포에 침투해 유전정보가 담긴 RNA(유전체 RNA·genomic RNA)를 복제하는 한편 유전체 RNA를 바탕으로 다양한 '하위유전체 RNA(subgemomic RNA)'를 생산(전사)한다. 이 하위유전체는 스파이크, 외피 등 바이러스 입자구조를 구성하는 여러 단백질을 합성하며 복제된 유전자와 함께 숙주세포 안에서 바이러스 완성체를 이룬다. 이후 세포를 탈출하여 새로운 세포를 감염시킨다. 숙주세포 안에서 생산된 RNA의 총합을 '전사체(Transcriptome)'라고 한다.
기존 연구에서 사스 코로나 바이러스-2의 유전체 정보가 보고되었지만, 유전체 RNA정보를 기반으로 유전자의 위치를 예측하는 수준에 머물렀다. 김 단장 연구팀은 이번 연구에서 유전체 RNA로부터 생산되는 하위유전체 RNA를 실험적으로 규명하고 각 전사체의 염기서열(유전정보)을 모두 분석해 유전체 RNA 상에 유전자들이 어디에 위치하는지 정확하게 찾아냈다.
기존에는 하위유전체 RNA 10개가 있다고 알려져 있었지만, 이번 실험으로 그중 9개의 하위유전체 RNA만 실제로 존재함을 확인했다. 나머지 하위유전체 RNA 1개에 대한 기존 예측과 다르게 실제로는 존재하지 않는 것으로 확인됐다. 연구팀은 세포 내에서 생산되는 RNA 수십여 종을 추가로 발견했다. 또 융합, 삭제 등 다양한 형태의 하위유전체 RNA 재조합도 빈번하게 일어남을 확인했다.
이와 함께 연구팀은 바이러스 RNA에서 메틸화와 같은 화학적 변형을 발견했다. DNA 메틸화처럼 DNA 수준에서 벌어지는 여러 생화학적 변화를 통칭하여 후성유전체(Epigenome)라 부르는 것처럼, 전사 후 RNA에서 벌어지는 다양한 생화학적 변화는 후성전사체(Epitranscriptome)라 한다. 전사 이후 변형된 RNA들은 기존에 알려지지 않은 새로운 특성을 가질 수 있으므로, 이번에 발견한 변형은 사스 코로나 바이러스-2의 생활사와 병원성을 이해하는 데 도움이 될 전망이다.
[사진=IBS 제공]
김빛내리 단장은 "새로 발견한 RNA들이 바이러스 복제와 숙주의 면역 반응을 조절하는 단백질로 작용하는지 확인해볼 필요가 있다. 또 RNA의 화학적 변형은 바이러스 생존 및 면역 반응과 관련이 있을 것으로 보인다"며 "이 RNA들과 RNA 변형은 바이러스 치료제를 개발할 때 새롭게 표적으로 삼을만한 후보군"이라고 말했다.
이어 "이번에 사스 코로나 바이러스-2 각 전사체의 정량을 정확하게 파악했으며, 이를 토대로 진단용 유전자증폭기술(PCR)을 개선할 수 있을 것"이라고 설명했다.
연구팀은 질병관리본부 국립보건연구원에서 숙주세포에 배양한 바이러스를 불활화한 후, 두 가지 차세대 염기서열 분석법을 함께 적용하여 새로운 사실을 찾아냈다. 특히 연구팀이 국내 최초로 도입한 '나노포어 직접 RNA 염기분석법'을 활용하면 사스 코로나 바이러스-2의 매우 긴 RNA 염기서열을 절단하지 않고 통째로 직접 분석할 수 있다.
일반적으로 RNA 염기서열 분석은 DNA로 변환한 뒤 분석하지만, 이 분석법은 RNA 염기를 변환과정 없이 그대로 읽어 분석할 수 있다. 즉, 원어를 번역하지 않고 직독 직해하는 것과 같다. 반면 'DNA 나노볼 염기분석법'은 염기서열을 한 번에 분석할 수는 없지만 높은 정확도와 대용량으로 분석할 수 있는 장점이 있어, 정확도가 낮고 적은 용량을 분석하는 나노포어 직접 RNA 염기분석법을 보완할 수 있다.
김 단장은 "이번 연구는 사스코로나바이러스-2 유전자에 대한 풍부한 정보와 세밀한 지도를 제시함으로써 바이러스의 증식원리를 이해하고 새로운 치료전략을 개발하는 데 기여할 것"이라고 말했다.
이번 연구결과는 생명과학 분야 학술지인 셀(Cell) 4월 9일자 온라인판에 게재됐다. 셀은 사안의 중대성을 감안해 논문 게재를 요청한 지 3주 만에 우선 게재했다.






![[지스타2024] 수능 끝난 인파로 북적…시연 대기만 2시간 넘어](https://image.ajunews.com/content/image/2024/11/15/20241115175429879608_388_136.jpg)
![[내일날씨] 흐리고 오후부터 전국 곳곳 비소식…낮 기온 18∼23도](https://image.ajunews.com/content/image/2024/11/15/20241115180913550550_388_136.jpg)
![[포토] 2년 만에 한중 정상회담](https://image.ajunews.com/content/image/2024/11/16/20241116022352106727_518_323.jpg)
![[포토] 이재명 대표, 항소할 것…수긍하기 어려운 결론](https://image.ajunews.com/content/image/2024/11/15/20241115153509481363_518_323.jpg)
![[포토] 이재명 대표 1심 선고공판 출석](https://image.ajunews.com/content/image/2024/11/15/20241115143148327390_518_323.jpg)
![[포토] 이재명 1심 선고 앞두고 열린 지지·반대 집회](https://image.ajunews.com/content/image/2024/11/15/20241115133121442343_518_323.jpg)


