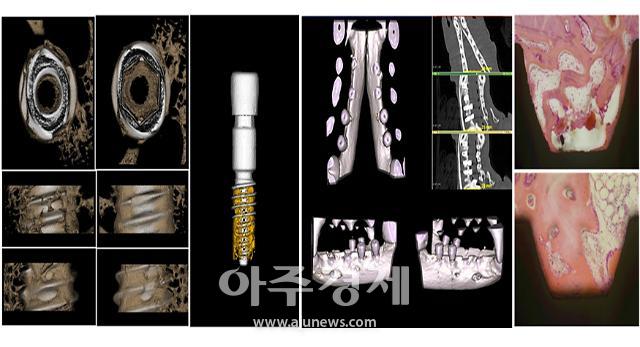
케이메디허브는 실제 임상과 유사한 환경에서 치과용 의료기기(임플란트, 골이식재)에 특화된 전임상 연구가 가능하도록 인프라를 구축하였으며, 치과용 임플란트 개발연구 사진이다. [사진=케이메디허브]
케이메디허브(대구경북첨단의료산업진흥재단)는 실제 임상과 유사한 환경에서 치과용 의료기기(임플란트, 골이식재)에 특화된 전임상 연구가 가능하도록 시스템을 구축했다고 18일 밝혔다.
이번 의료기기의 인허가를 위해 최종적으로 실험동물에서 평가가 요구되는 품목이 있는데 치과에서 사용되는 임플란트나 골이식재는 구강 내 적용이 어려워 대다수 대체 부위(머리뼈, 정강이뼈 등)에서 관련 연구가 수행됐다.
이에 국내 임플란트 기업의 애로사항을 미리 파악한 케이메디허브는 수년간의 준비 끝에 국제적 요구 사항을 충족시킬 수 있는 치과용 의료기기 전임상 평가 시스템을 구축했다.
케이메디허브는 치과용 의료기기(임플란트, 골이식재)의 임상 적응증을 대표할 수 있는 전임상 유효성 평가 시스템(실험동물 모델/의료기기 적용/분석 및 평가)을 구축했다.
케이메디허브 전임상센터의 의료기기 평가 기반 기술을 바탕으로 계명대학교 동산병원 치과(신영민 교수)와 치과용 의료기기 연구개발 기업들과의 지속적인 교류를 통해 점차 개선되어, 현재 한층 고도화된 치과용 임플란트 고정체, 골이식재 유효성 평가를 제공할 수 있게 되었다.
해당 기술은 비글 구강 내 국소 무치악 모델을 제작하여, 임플란트나 골이식재와 같은 치과용 의료기기를 평가하는 기술로, 실제 임상과 같은 수술 도구, 장비, 수술법을 적용할 수 있게 했다.
또한, 수시로 외부 온도, 각종 미생물, 물리적 충격 등의 다양한 자극이 동반되는 구강이라는 특수한 환경적 요인을 제공함으로써 평가 결과의 신뢰성을 높였다.
케이메디허브는 구축된 치과용 의료기기 유효성 평가 기술을 바탕으로 차세대 의료연구기반 육성 사업을 통해 올해를 시작으로 약 2년간 10억 원 규모로 기업의 치과용 의료기기의 해외 인허가 지원을 시작한다.
유럽의 의료기기 인증 규정 개정에 따라 향후 임상 평가 및 시판 후 후속 조치가 더 엄격해지고 있으며 이는 미국, 일본 등 다른 국가에도 영향을 미칠 것으로 예상된다.
양진영 케이메디허브 이사장은 “기술적 장벽으로 인해 유럽, 미국 수출을 고민하는 국내 임플란트 기업이 케이메디허브를 발판 삼아 세계적인 기업으로 성장할 수 있도록 적극적으로 돕겠다”고 말했다.








![[포토] 윤대통령, 2차 출석요구 불응…공수처 오늘은 기다려볼 것](https://image.ajunews.com/content/image/2024/12/25/20241225120851969194_518_323.jpg)
![[포토] 어지러운 세상, 잠시만 잊고 메리크리스마스](https://image.ajunews.com/content/image/2024/12/24/20241224205253484194_518_323.jpg)
![[포토] 2025 아주경제 미래 전망 총장 포럼](https://image.ajunews.com/content/image/2024/12/23/20241223204826600972_518_323.jpg)
![[슬라이드 포토] 2024 SBS 연기대상 레드카펫을 빛낸 배우들](https://image.ajunews.com/content/image/2024/12/21/20241221223535311348_518_323.jpg)


