
[보건복지부]
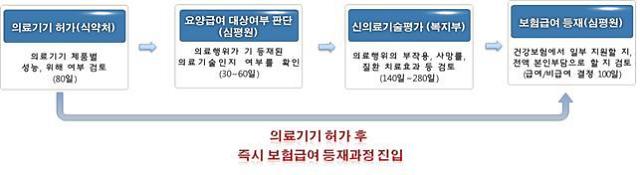
이에 따라 약 390일 기간이 걸리던 감염병 체외진단검사 건강보험등재 절차가 140일로 줄어들 전망이다.
의료기기 규제혁신 방안은 안전성 우려가 적은 의료기기를 시장에 선(先)진입하게 하고, 후(後)평가하는 방식을 적용하는 것이다. 체외진단검사는 사람의 몸 밖에서 질병을 진단하기 때문에 비교적 안전한 의료기술로 평가되고 있다.
식품의약품안전처 허가를 통과해 의료기기 안전성을 검증받은 감염병 체외진단검사는 관련 서류를 갖출 경우 신의료기술평가 없이 곧바로 건강보험을 신청할 수 있다.
체외진단검사 선 진입-후 평가의 도입 효과 [사진=보건복지부 제공 ]
때문에 복지부는 감염병 체외진단검사부터 건강보험에 등재시키는 절차를 개선한 후 하반기에는 신의료기술평가에 관한 규칙 등 법령 개정을 통해 체외진단검사 전체를 대상으로 본 사업을 확대·시행할 계획이다.
이번 시범사업은 선(先) 진입하는 의료기술에 대한 사후관리·감독 체계를 점검하기 위해 진단검사의학과 전문의 또는 병리과 전문의가 근무하는 종합병원급 이상 의료기관에서 우선 실시한다.
시범사업 기간 동안 신청인은 한국보건의료연구원에 의료현장 활용 결과를 분기별로 보고해야 한다. 신의료기술평가위원회는 이를 토대로 관리·감독 및 1∼5년 후 신의료기술 승인여부를 결정한다.
시범사업 신청은 오는 1일부터 한국보건의료연구원을 통해 가능하다.
손호준 보건복지부 의료자원정책과장은 “감염병 체외진단검사 건강보험 등재절차 개선 시범사업을 통해 기존에 오랜 시간이 걸리던 의료기기 시장 진입 절차를 보다 합리적으로 개선해 나갈 것”이라며 “이번 시범사업을 통해 관리·감독 체계를 점검해 하반기 예정된 본 사업을 조속히 추진할 것”이라고 말했다.








![[날씨] 아침 기온 0도 안팎 뚝…일교차 15도 내외](https://image.ajunews.com/content/image/2024/11/23/20241123161702152439_388_136.jpg)
![[슬라이드 포토] 성수동이 들썩 오데마 피게 포토콜 참석한 스타들](https://image.ajunews.com/content/image/2024/11/22/20241122205657914816_518_323.jpg)
![[포토] 제8회 서민금융포럼](https://image.ajunews.com/content/image/2024/11/21/20241121114536531007_518_323.jpg)
![[포토] 기조연설 하는 페이커 이상혁](https://image.ajunews.com/content/image/2024/11/20/20241120115246771576_518_323.jpg)
![[포토] 발왕산은 벌써 겨울](https://image.ajunews.com/content/image/2024/11/19/20241119205226273772_518_323.jpg)


