김형기 교수(고려대학교) 연구팀은 미래부 기초연구사업(개인연구)과 보건복지부 세계선도 의생명과학자 육성사업(개인연구)의 지원으로 이번 연구를 수행했다. 연구결과는 세포생물학 분야 국제적 저명 학술지 셀 리포트(Cell Reports) 7월 28일자에 게재됐다.
그간 암 생성과 전이에 중요한 역할을 하는 암줄기세포에 대한 연구가 활발히 이뤄지고 있다. 현재 암줄기세포는 항암 방사선 치료에 대한 내성이 높아 암 재발 가능성을 높이는 주요 원인으로 알려져 있다.
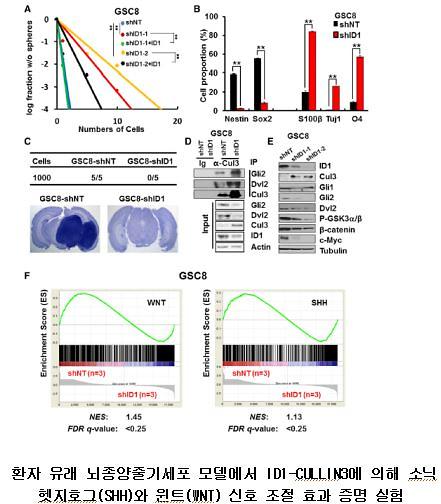
정상적인 성체줄기세포와 유사하게, 암줄기세포도 혈관 주변 혹은 저산소 지역과 같은 종양 미세환경에 의존하며 생존하는 것으로 알려져 있다. 하지만 종양 미세환경이 형성될 가능성이 낮은 암 발생 초기에는 이들 미세환경-뇌종양줄기세포 가설에 의한 암 발생을 설명하기에는 한계가 있었다.
이에 연구팀은 암줄기세포 미세환경이 없는 곳에서도 뇌종양줄기세포 스스로가 줄기세포의 특성을 유지하며 암 생성을 촉진할 수 있는 새로운 메커니즘이 존재할 것이라는 가설을 제시했다.
정상적인 줄기세포 미세환경에서는 외부신호 전달물질인 소닉헷지호그(SHH)와 윈트(WNT)가 분비돼 줄기세포 신호를 활성화시켜 정상 줄기세포를 유지시킨다. 연구팀은 그러나 줄기세포가 생존하기 어려운 환경에서도 외부신호의 도움 없이 뇌종양줄기세포가 성장하고 암세포가 성장하는 것을 확인했다.
연구팀은 뇌종양줄기세포 내 높게 발현하고 있는 세포분화억제인자인(ID1) 단백질이 외부 신호 없이도 암줄기세포를 유지시키고 악성암이 성장할 수 있도록 돕는다는 사실을 밝혀냈다.
또한 이러한 세포 내재적으로 생성되는 다양한 줄기세포 신호조절 메커니즘은 346명의 환자 데이터를 분석한 결과, 48명에서 활성화되어 있는 것을 확인했다. 이들 신호를 암줄기세포에서 동시에 제어했을 때 암줄기세포의 특성을 효과적으로 억제하는 것을 규명하면서 새로운 뇌종양 치료방안을 제시하기도 했다.
미래부는 이번 연구가 종양의 생성, 성장, 침윤 및 전이, 재성장 및 항암치료 후 재발과 같은 암 다이나믹스를 제어할 수 있는 진정한 암 줄기세포 표적 정밀치료(precision therapy)로 발전될 수 있을 것으로 내다봤다.
김형기 교수는 "각 암줄기세포 특성에 따라 표적 맞춤형 복합 항암치료를 하는 것이 암의 전이나 재발을 방지할 수 있는 새로운 치료 대안이 될 것"이라고 말했다.








![[날씨] 전국 흐리고 기온 뚝…오후부터 차차 맑아져](https://image.ajunews.com/content/image/2024/11/16/20241116231917549752_388_136.jpg)
![[포토] 정권 규탄하는 시민들](https://image.ajunews.com/content/image/2024/11/16/20241116185150435012_518_323.jpg)
![[포토] 악수하는 윤석열 대통령과 시진핑 주석](https://image.ajunews.com/content/image/2024/11/16/20241116123111698176_518_323.jpg)
![[포토] 이재명 대표, 항소할 것…수긍하기 어려운 결론](https://image.ajunews.com/content/image/2024/11/15/20241115153509481363_518_323.jpg)
![[포토] 이재명 대표 1심 선고공판 출석](https://image.ajunews.com/content/image/2024/11/15/20241115143148327390_518_323.jpg)


