GC녹십자·셀트리온·대웅제약 등 국내 기업에서 개발 중인 신종 코로나바이러스 감염증(이하 코로나19) 치료제가 최근 치료목적 사용 승인을 연이어 받으면서 상용화 기대감이 높아지고 있다.
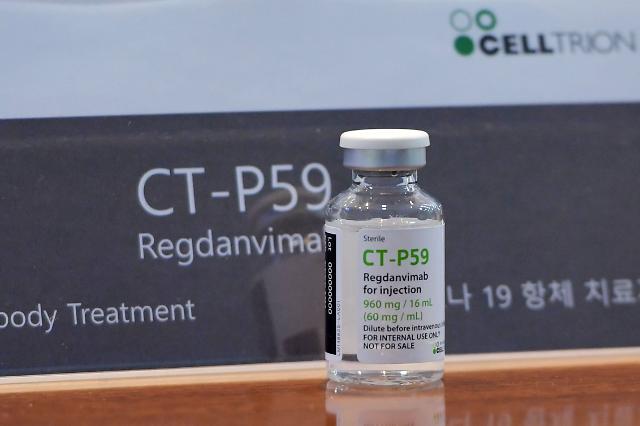
22일 제약·바이오업계에 따르면 셀트리온은 빠르면 이번 주 질병관리청에 셀트리온의 코로나19 치료제 CT-P59 긴급사용승인을 신청할 전망이다.
긴급사용승인 여부는 식약처가 결정하며, 통상 40일 이내에 허가를 결정해 왔다.
셀트리온은 지난달 25일 코로나19 항체치료제 CT-P59의 글로벌 임상 2상 환자 모집과 투약을 완료했다. 327명의 참여자를 위약 투여군, 저농도 투여군, 고농도 투여군 등으로 분류해 효능, 안전성, 적정 투약 용량 등을 확인하고 있는 것으로 알려졌다.
셀트리온 치료제가 최근 서울아산병원에서 치료목적사용승인을 받으면서 상용화 기대감이 더욱 높아지고 있다. 치료목적사용승인은 특정 환자만 치료에 사용할 수 있게 식약처의 허용을 받는 것으로, 임상시험이나 특례승인과는 별개다.
GC녹십자도 혈장 치료제 GC5131A 임상 2상 결과 발표를 앞둔 상태다. GC녹십자의 혈장 치료제 임상시험은 60명을 대상으로 임상 2상 참여자 중 50명을 모집한 것으로 알려졌다. GC녹십자는 일단 오는 2021년 2월까지 임상을 진행한다는 계획이지만 조만간 중간 결과를 발표할 전망이다.
GC녹십자의 혈장 치료제도 최근 서울아산병원에서 치료목적사용승인을 받았다. 이로써 GC녹십자의 혈장치료제를 투여 받거나 준비 중인 환자는 26명으로 늘었다. 혈장치료제가 20명 넘는 환자에게 사용되면서 의약품 안전성은 입증됐다는 평가가 나온다.
의료 현장 수요 대응을 위해 GC녹십자는 지난달 30일 코로나19 혈장치료제 제3차 생산을 완료했다.
한편, 이날 질병관리청 중앙방역대책본부는 국내 코로나19 백신 개발 현황을 발표했다.
방대본에 따르면 코로나19 백신 분야에서는 현재 민간개발 4종 백신이 국내 임상시험 승인을 받았다.
제넥신이 개발 중인 코로나19 백신 'GX-19/GX19N'은 DNA백신으로 지난 6월 11일 1/2a상 임상시험이 승인됐다. 제넥신은 오는 2021년 상반기에 2b/3상 임상시험을 진행할 계획이다.
SK바이오사이언스가 개발 중인 백신 'NBP2001'는 합성항원 백신으로 지난달 23일 1상 임상시험이 승인됐다. SK바이오사이언스는 2021년 상반기에 2상, 하반기에 3상을 진행한다는 계획이다.
아울러 진원생명과학의 'GLS-5310'과 셀리드의 'AdCLD-CoV19' 백신은 각각 지난 4일 1/2a 상 임상시험 승인을 받았다. 두 백신 모두 2021년 하반기에 2b/3상 임상시험을 실시할 계획이다.

셀트리온이 개발 중인 신종 코로나바이러스 감염증(코로나19) 항체치료제 'CT-P59'를 22일 공개했다. [사진=연합뉴스]
22일 제약·바이오업계에 따르면 셀트리온은 빠르면 이번 주 질병관리청에 셀트리온의 코로나19 치료제 CT-P59 긴급사용승인을 신청할 전망이다.
긴급사용승인 여부는 식약처가 결정하며, 통상 40일 이내에 허가를 결정해 왔다.
셀트리온은 지난달 25일 코로나19 항체치료제 CT-P59의 글로벌 임상 2상 환자 모집과 투약을 완료했다. 327명의 참여자를 위약 투여군, 저농도 투여군, 고농도 투여군 등으로 분류해 효능, 안전성, 적정 투약 용량 등을 확인하고 있는 것으로 알려졌다.
GC녹십자도 혈장 치료제 GC5131A 임상 2상 결과 발표를 앞둔 상태다. GC녹십자의 혈장 치료제 임상시험은 60명을 대상으로 임상 2상 참여자 중 50명을 모집한 것으로 알려졌다. GC녹십자는 일단 오는 2021년 2월까지 임상을 진행한다는 계획이지만 조만간 중간 결과를 발표할 전망이다.
GC녹십자의 혈장 치료제도 최근 서울아산병원에서 치료목적사용승인을 받았다. 이로써 GC녹십자의 혈장치료제를 투여 받거나 준비 중인 환자는 26명으로 늘었다. 혈장치료제가 20명 넘는 환자에게 사용되면서 의약품 안전성은 입증됐다는 평가가 나온다.
의료 현장 수요 대응을 위해 GC녹십자는 지난달 30일 코로나19 혈장치료제 제3차 생산을 완료했다.

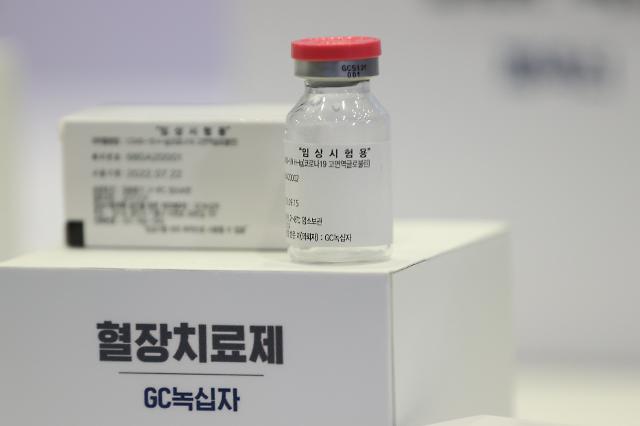
지난 10월 15일 오후 경기도 성남 소재 SK바이오사이언스에서 열린 '코로나19 백신·치료제 개발 현장간담회'에 전시된 GC녹십자 혈장치료제 임상시약. [사진=연합뉴스]
한편, 이날 질병관리청 중앙방역대책본부는 국내 코로나19 백신 개발 현황을 발표했다.
방대본에 따르면 코로나19 백신 분야에서는 현재 민간개발 4종 백신이 국내 임상시험 승인을 받았다.
제넥신이 개발 중인 코로나19 백신 'GX-19/GX19N'은 DNA백신으로 지난 6월 11일 1/2a상 임상시험이 승인됐다. 제넥신은 오는 2021년 상반기에 2b/3상 임상시험을 진행할 계획이다.
SK바이오사이언스가 개발 중인 백신 'NBP2001'는 합성항원 백신으로 지난달 23일 1상 임상시험이 승인됐다. SK바이오사이언스는 2021년 상반기에 2상, 하반기에 3상을 진행한다는 계획이다.
아울러 진원생명과학의 'GLS-5310'과 셀리드의 'AdCLD-CoV19' 백신은 각각 지난 4일 1/2a 상 임상시험 승인을 받았다. 두 백신 모두 2021년 하반기에 2b/3상 임상시험을 실시할 계획이다.








![[날씨] 아침 기온 0도 안팎 뚝…일교차 15도 내외](https://image.ajunews.com/content/image/2024/11/23/20241123161702152439_388_136.jpg)
![[슬라이드 포토] 성수동이 들썩 오데마 피게 포토콜 참석한 스타들](https://image.ajunews.com/content/image/2024/11/22/20241122205657914816_518_323.jpg)
![[포토] 제8회 서민금융포럼](https://image.ajunews.com/content/image/2024/11/21/20241121114536531007_518_323.jpg)
![[포토] 기조연설 하는 페이커 이상혁](https://image.ajunews.com/content/image/2024/11/20/20241120115246771576_518_323.jpg)
![[포토] 발왕산은 벌써 겨울](https://image.ajunews.com/content/image/2024/11/19/20241119205226273772_518_323.jpg)


