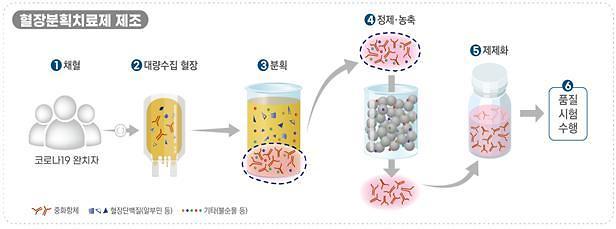
[자료=식품의약품안전처 제공]
이번에 미국에서 긴급사용으로 승인받은 혈장치료(Convalescent Plasma)는 소수의 코로나19 완치자로부터 채혈한 회복기혈장을 그대로 환자에게 주입하는 수혈요법으로, 혈장 공여자에 따라 중화항체(면역글로불린)의 효과가 각기 다르다.
앞서 국내에서도 코로나19 완치자의 혈장을 이용한 치료 결과가 발표된 바 있다.
지난 4월 연세대학교의과대학 세브란스병원에서는 중증환자 2명이 혈장치료 후 완치됐으며, 지난달에는 인하대학교의과대학 부속병원에서 7명의 중증환자에게 혈장치료를 실시한 결과, 5명이 완치판정을 받았다.
혈장분획치료제의 경우 녹십자에서 개발한 ‘GC5131’ 제품이 지난 20일 식약처의 2상 임상을 승인받았으며, 9월 초 첫 환자가 등록될 것으로 예상된다. 올해 말까지 2상을 완료하는 것을 목표로 하고 있다.
현재 해외에서도 혈장치료제를 개발하고 있다. 프랑스와 중국, 일본 및 이탈리아에서 혈장치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
한편, FDA는 현지시간으로 23일 혈장치료를 코로나19 치료로 긴급사용 승인했다. 지금까지 코로나19 환자 7만명이 혈장치료 처방을 받았으며, 이 중 2만명을 분석한 결과, 치료의 안전성을 확인했다고 밝혔다.





![[단독] 이주노동자 계속 느는데…이달부터 국가 간 송금 서비스 중단](https://image.ajunews.com/content/image/2024/12/02/20241202142820898872_388_136.jpg)



![[포토] 나눔온도 100도를 향해](https://image.ajunews.com/content/image/2024/12/02/20241202191242963724_518_323.jpg)
![[포토] 대구 아파트 화재 합동 감식](https://image.ajunews.com/content/image/2024/12/02/20241202121504790080_518_323.jpg)
![[포토] 녹색소비자연대전국협의회, 화학물질저감 우수제품 발표](https://image.ajunews.com/content/image/2024/12/02/20241202121630980826_518_323.jpg)
![[포토] 제45회 청룡영화상 레드카펫 빛낸 스타들](https://image.ajunews.com/content/image/2024/11/29/20241129204257434702_518_323.jpg)


