[사진=식약처 제공 ]
25일 식품의약품안전처에 따르면 지난해 임상시험계획 승인 건수는 675건으로 전년(652건) 대비 3.5% 증가했다. 임상시험 승인은 지난 2011년 503건에서 4년 만에 172건 이상 늘어날 정도로 매년 꾸준히 상승하고 있다.
국내 제약사의 임상시험 승인건수는 245건으로 전년(220건)대비 11.4% 늘었다. 다국적 제약사의 승인건수는 2014년 285건에서 지난해 296건으로 3.9% 증가했다.
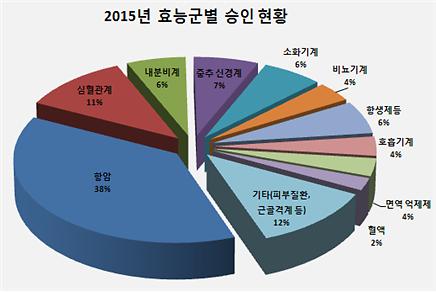
임상시험을 효능군 별로 살펴보면 항암제가 255건으로 가장 많았다. 특히 면역세포를 활성화해 암세포를 죽이는 면역항체항암제 등에 대한 개발이 활발했다. 이어 심혈관계(76건), 중추신경계(46건), 내분비계(42건) 등의 순으로 많았다.
국내 제약사 중 가장 많이 임상시험승인을 받은 기업은 종근당(30건)이었다. 그 뒤로 한미약품(18건), CJ헬스케어(11건), 일동제약(11건) 등의 순이었다.
다국적 제약사의 경우 한국노바티스(18건), 한국얀센(18건), 한국엠에스디(17건), 한국아스트라제네카(15건) 등으로 임상이 활발했다.
임상시험수탁기관(CRO) 가운데는 퀸타일즈트랜스내셔널코리아(35건)가 가장 많았고, 피피디디벨럽먼트피티이엘티디(17건), 파마수티컬리서치어소시에이츠코리아(13건) 등도 높았다.
한편, 국내 제약사는 임상시험 초기 단계인 1상임상시험 승인건수가 2014년 152건에서 지난해 148건으로 소폭 감소했지만, 임상2상(42건)과 3상(53건)은 각각 68%, 26% 급증했다.
식약처 관계자는 “2상과 3상이 늘어난 것은 의약품 개발을 위한 투자가 활성화되고 1상 임상시험에서 제품화 가능성을 확인한 품목들이 다음단계 임상으로 많이 진입했기 때문”이라고 설명했다.
다국적 제약사 임상시험의 경우 올해는 3상이 다소 감소한 반면 1상과 2상은 증가했다.
처는 국내 임상시험 수행에 대한 신뢰도가 높아져 제품 개발의 성패를 좌우하는 초기 단계 임상시험을 한국에서 많이 실시한 것으로 분석했다.
식약처 관계자는 "국내 제약사 등이 체계적이고 효율적인 임상시험을 실시할 수 있도록 지속적으로 지원할 것"이라며 "앞으로도 국제 조화 및 품질향상은 물론 임상시험 참여자 안전을 강화할 계획"이라고 밝혔다.


![[2024 서민금융포럼] 이복현 금감원장 서민금융 위한 포괄적 선택지 모색해야](https://image.ajunews.com/content/image/2024/11/21/20241121133047477780_388_136.jpg)





![[포토] 제8회 서민금융포럼](https://image.ajunews.com/content/image/2024/11/21/20241121114536531007_518_323.jpg)
![[포토] 기조연설 하는 페이커 이상혁](https://image.ajunews.com/content/image/2024/11/20/20241120115246771576_518_323.jpg)
![[포토] 발왕산은 벌써 겨울](https://image.ajunews.com/content/image/2024/11/19/20241119205226273772_518_323.jpg)
![[슬라이드 포토] 제44회 황금촬영상 시상식 참석한 스타들](https://image.ajunews.com/content/image/2024/11/18/20241118194949259743_518_323.jpg)


