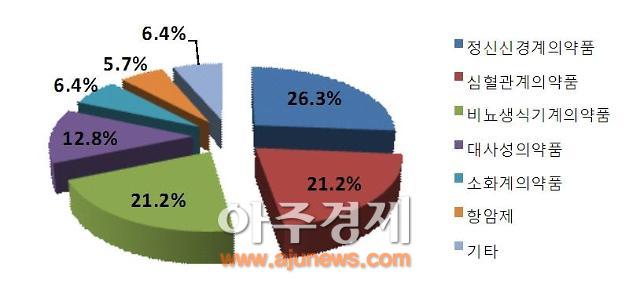
2014년 치료영역별 분포 [자료=식품의약품안전처]
5일 식품의약품안전처가 지난 한 해 제네릭의약품 개발을 위한 생물학적동등성(생동성) 시험 계획 승인 현황을 분석한 결과를 보면 총 승인 건수는 156건으로, 전년도 163건보다 소폭 줄었다.
치료영역별로는 소염진통제, 우울장애, 관절염치료제 등 정신신경계의약품이 41건(26.3%)으로 가장 많았다. 정신신경계의약품 생동성 시험이 심혈관계의약품을 제치고 가장 많이 승인된 것은 2011년 이후 처음이다.
이어 비뇨·생식기계의약품과 심혈관계의약품이 각각 33건(21.2%)로 뒤를 이었다.
비뇨·생식기계의 경우 올해 9월 특허가 종료될 예정인 발기부전치료제 '시알리스'의 성분인 '타다라필'의 생동성시험이 20건이나 승인되며 단일 성분 가운데 가장 많았다.
정신신경계의약품의 제네릭 개발 증가는 현대사회의 스트레스 증가와 고령화 등의 영향과 치료 목적 외에 삶의 질을 높이는 제품의 시장 수요를 반영해 비뇨·생식기계의약품의 개발이 두드러진 것으로 풀이된다.
오리지널 의약품의 제형이나 함량을 바꾸기 위한 제약사의 개발 노력도 활발했다.
제형 변경 등을 위한 생동성시험 승인 건수는 지난해 모두 28건으로, 2013년 6건에 비해 크게 늘었다.
올해 6월 특허가 종료되는 관절염치료제 '세레콕시브'를 캡슐에서 알약으로 바꾸기 위한 생동성시험이 9건 승인됐다.
식약처 관계자는 "단순 제네릭의약품에서 벗어나 새로운 제형 개발 등을 위한 새로운 패턴의 생동성 시험이 계속 증가할 것"으로 전망했다.







![[날씨] 아침 기온 0도 안팎 뚝…일교차 15도 내외](https://image.ajunews.com/content/image/2024/11/23/20241123161702152439_388_136.jpg)
![[슬라이드 포토] 성수동이 들썩 오데마 피게 포토콜 참석한 스타들](https://image.ajunews.com/content/image/2024/11/22/20241122205657914816_518_323.jpg)
![[포토] 제8회 서민금융포럼](https://image.ajunews.com/content/image/2024/11/21/20241121114536531007_518_323.jpg)
![[포토] 기조연설 하는 페이커 이상혁](https://image.ajunews.com/content/image/2024/11/20/20241120115246771576_518_323.jpg)
![[포토] 발왕산은 벌써 겨울](https://image.ajunews.com/content/image/2024/11/19/20241119205226273772_518_323.jpg)


