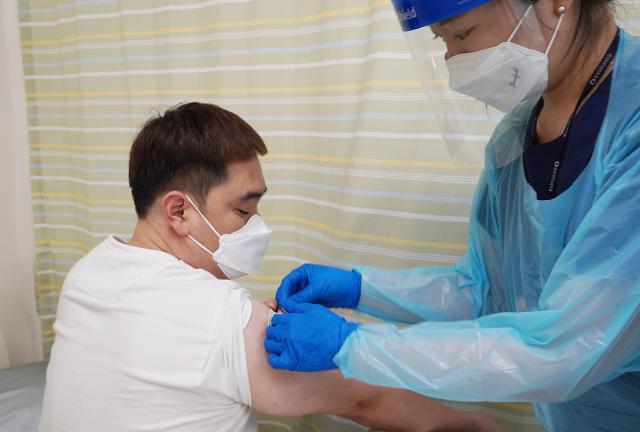
30일 부산 동아대학교병원에서 GBP510 임상3상을 위한 피험자 투여가 진행되고 있다. [사진=SK바이오사이언스]
SK바이오사이언스가 자체 개발한 코로나19 백신 임상 3상을 본격적으로 시작했다. 국내 식약처의 IND(임상시험계획) 승인 후 약 3주 만으로, 국내에서 개발된 코로나19 백신 후보물질의 첫 임상 3상 투약이다.
SK바이오사이언스는 30일 미국 워싱턴대학 항원디자인연구소(Institute for Protein Design, IPD)와 공동으로 개발한 코로나19 백신 후보물질 GBP510의 임상 3상 시험 첫 피험자 투여를 개시했다고 밝혔다.
GBP510의 임상 3상은 향후 고려대 구로병원 등 국내 14개 기관과 유럽, 동남아 등 해외 기관에서 만 18세 이상의 국내외 성인 4000여 명을 대상으로 진행된다.
GBP510은 유전자 재조합 기술로 만들어진 합성항원 백신으로 GSK의 팬데믹 면역증강제와 혼합해 28일 간격으로 2회 근육 투여하는 방식이다.
SK바이오사이언스는 동유럽, 동남아 등 해외에서도 국제백신연구소와 손잡고 각 국가별 임상 3상 IND 승인을 신청 중으로 빠르면 다음달부터 임상에 돌입할 계획이다.
SK바이오사이언스는 국내외에서 진행되는 임상 3상을 통해 GBP510의 면역원성 및 안전성을 평가해 내년 상반기엔 중간 데이터를 확보, 국내 보건당국의 신속 허가를 받고 WHO의 사전적격성평가 인증과 각 국가별 긴급사용허가 획득 준비 절차에도 돌입할 예정이다.
SK바이오사이언스 관계자는 "GBP510은 개발이 완료되면 수입에 의존하고 있는 국내 코로나19 백신 수급 상황의 어려움을 해소하는 단초가 될 전망"이라며 "SK바이오사이언스가 개발한 국산 백신인 만큼 자체적으로 생산 및 공급 계획을 수립해 공급할 수 있고 장기적으로는 플랫폼 기술을 기반으로 변이 바이러스에 빠르게 대처할 수 있어 백신 주권을 확보하는 데 기여하게 될 것"이라고 내다봤다.
GBP510에 적용된 합성항원 백신 플랫폼은 2∼8도의 냉장 조건에서 보관이 가능해 기존 백신 물류망을 활용해 유통할 수 있고 장기보관도 가능할 것으로 예상돼 글로벌에서도 접근성을 용이하게 확보할 수 있을 전망이다.
안재용 SK바이오사이언스 사장은 "임상을 통해 안전성과 효과성을 철저히 검증해 대한민국 국민, 더 나아가 전 인류가 안심하고 백신을 접종할 수 있는 기반을 마련하겠다"고 밝혔다.
한편, SK바이오사이언스는 앞서 건강한 성인 80명을 대상으로 진행한 임상1/2상 스테이지1결과 GBP510과 면역증강제를 함께 투여한 투약군에서 코로나19 바이러스를 무력화하는 중화항체가 100% 형성되는 것을 확인했다.
안전성 측면에서도 GBP510 투약과 관련성이 있는 중대한 이상반응은 한 건도 발생하지 않아 충분한 내약성을 확보한 것으로 나타났다. SK바이오사이언스는 고령자까지 포함된 스테이지2 참여자 247명에 대해서도 투약을 마치고 안전성을 추적 관찰 중으로, 현재까지 특별한 안전성 문제는 발생하지 않았다.








![[날씨] 전국 흐리고 눈비…미세먼지는 좋음](https://image.ajunews.com/content/image/2025/03/16/20250316062142985743_388_136.jpg)
![[슬라이드 포토] 故 휘성, 영정 사진 속 환한 미소](https://image.ajunews.com/content/image/2025/03/14/20250314131052257994_518_323.jpg)
![[포토] 홈플러스, 정산 대금 3400억 지급…현금 1600억 보유](https://image.ajunews.com/content/image/2025/03/14/20250314104411947330_518_323.jpg)
![[포토] 최재해 감사원장, 기각 후 업무 복귀](https://image.ajunews.com/content/image/2025/03/13/20250313120924594304_518_323.jpg)
![[포토] 국민의힘, 헌재 앞 기자회견](https://image.ajunews.com/content/image/2025/03/13/20250313120803802996_518_323.jpg)


