이미지 확대
미래부에 따르면 백성희 교수(서울대학교) 연구팀은 미래부 기초연구사업 지원으로 이번 연구를 수행했으며, 이 연구는 세계 3대 저널인 네이처에 15일자에 온라인으로 게재됐다.
오토파지는 불필요한 세포내 단백질 및 손상된 세포내 소기관을 분해하는 역할을 하고, 세포내 필요한 물질들을 합성해 세포의 생존과 항상성 유지에 필수적 역할을 한다.
현재까지는 연구 대부분이 세포질에서 오토파지 단백질들이 어떻게 결합하고 기능하는지에 초점이 맞춰져 있었다. 핵 내에서 일어나는 유전자 발현 및 전사 조절에 대한 연구는 전무한 상황이었다.
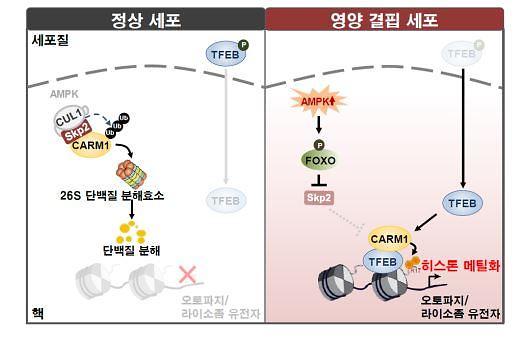
이러한 가정에 기반해 다양한 영양분 결핍 상황에서 히스톤 단백질의 변형을 관찰한 결과 히스톤 H3의 아르기닌 17번 잔기에 메틸화가 유도됨을 확인했다. 또 이러한 메틸화를 유도하는 CARM1 효소의 단백질 양 또한 증가되는 것을 관찰했다.
백 연구팀은 CARM1 단백질 복합체 정제를 통해 정상 상황에서는 SKP2-SCF E3 유비퀴틴화 효소에 의해 CARM1 단백질이 분해되지만, 영양분 결핍 상황에서는 SKP2의 전사가 감소돼 CARM1 단백질이 분해되지 않고 안정화되는 것을 확인했다.
특히 세포에 당 결핍 상황이 지속될 경우 AMPK(AMP-activated protein kinase) 인산화 효소가 활성화 되면서 FOXO3라는 전사 인자를 인산화 시키고, CARM1 단백질이 안정화 된다는 것을 규명했다.
백 연구팀은 이렇게 새롭게 발굴한 AMPK-SKP2-CARM1로 연결되는 신호전달 경로가 오토파지가 유도되는 상황에서 필수적인 신호전달 경로임을 최초로 규명하는데 성공했다.
즉 오토파지를 유도하는 다양한 신호에 의해 CARM1 단백질이 안정화되고, 핵 내에서 히스톤 아르기닌 잔기의 메틸화가 유도됨에 따라 핵심적인 오토파지 유전자들의 발현을 조절할 수 있다는 사실을 규명한 것이다.
히스톤 아르기닌 메틸화를 저해하는 저해제인 엘라그산(Ellagic acid)은 베리류에서 많이 검출되는 화학물질로, 말라리아 치료제로 사용되고 있다.
미래부는 이번 연구를 통해서 오토파지 유도에 중요한 히스톤의 아르기닌 잔기의 메틸화를 억제해 후성유전적 조절을 하는 것을 확인했으며, 이러한 엘라그산의 효과를 마우스 모델을 이용한 실험을 통해 검증했다고 밝혔다.
또 이번 연구는 핵 내에서 일어나는 오토파지의 중요한 신호 전달 경로를 발굴하고 여기에 핵심적인 CARM1 단백질을 발견하는 등 오토파지의 후성유전 및 전사 조절 기전을 세계 최초로 규명했다고 설명했다.
백 교수는 "이번 연구에서 발굴한 오토파지 조절에 필수적인 신호전달 경로를 표적으로 하는 신개념 치료제 개발이 가능할 것"이라고 내다봤다.








![[포토] 윤석열 대통령, 탄핵심판 8차 변론 참석](https://image.ajunews.com/content/image/2025/02/13/20250213102754205067_518_323.jpg)
![[포토] 제1회 아주이노베이션 리더 대상](https://image.ajunews.com/content/image/2025/02/12/20250212161117385058_518_323.jpg)
![[포토] 별이 된 8살 하늘이](https://image.ajunews.com/content/image/2025/02/11/20250211231513478401_518_323.jpg)
![[포토] 윤석열 대통령, 탄핵심판 7차 변론 출석](https://image.ajunews.com/content/image/2025/02/11/20250211111020195565_518_323.jpg)


