[코로나19] 식약처, GC녹십자 혈장치료제 임상2상 승인
2020-08-20 09:31
코로나19 치료제·백신 국내 임상시험 총 16건 진행 중
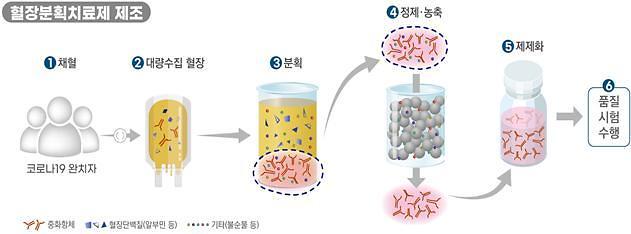
혈장분획치료제 제조방법 [자료=식품의약품안전처 제공]
GC5131은 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품이다. 혈장분획치료제는 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화하는 것으로, 코로나19 중화항체(바이러스 무력화 항체)가 농축된 면역글로불린(혈장 성분 중 면역에 중요한 역할을 하는 단백질)을 이용한다.
식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔다. 그 결과, 원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발됨에 따라 임상1상을 면제하고 2상 허가를 승인했다.
현재 프랑스와 중국, 일본 및 이탈리아에서도 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
식약처 관계자는 “코로나19 치료제·백신 개발에 대한 국민적 관심이 큰 만큼 앞으로도 국내 개발 제품의 임상시험 현황에 대해 신속하게 정보를 전달하겠다”며 “또 안전하고 효과 있는 코로나19 치료제·백신이 신속히 개발될 수 있도록 최대한 지원하겠다”고 전했다.
